Artículo de investigación – Revista Frontiers
Sec. Ginecología
Volumen 5 – 2023 | https://doi.org/10.3389/frph.2023.1321284
* Traducción automática al español
Antecedentes: los niveles bajos de estradiol sérico al comienzo del embarazo se asocian con un riesgo elevado de aborto espontáneo. Intentamos determinar si los esfuerzos para restablecer los niveles bajos de estradiol en sangre mediante la suplementación con estradiol o dehidroepiandrosterona (DHEA) reducirían el riesgo de aborto espontáneo como parte de un protocolo de tratamiento multifactorial basado en síntomas.
Métodos: Este estudio de cohorte retrospectivo incluyó mujeres con niveles bajos de estradiol sérico al comienzo del embarazo, definidos como ≤50% de los niveles de referencia por edad gestacional. El estradiol o la DHEA se administraron por vía oral y la medida de resultado primaria fue el nivel de estradiol sérico, en referencia a la edad gestacional. Las medidas de resultado secundarias incluyeron aborto espontáneo, peso al nacer y edad gestacional al nacer.
Resultados: No encontramos ningún efecto significativo de la suplementación con estradiol sobre los niveles séricos de estradiol referidos a la edad gestacional, mientras que la suplementación con DHEA aumentó fuertemente los niveles de estradiol. Para los embarazos con niveles bajos de estradiol, la tasa de aborto espontáneo en el grupo no suplementado fue del 45,5%, mientras que la tasa de aborto espontáneo en los grupos suplementados con estradiol y DHEA fue del 21,2% ( p = 0,067) y del 17,5% ( p = 0,038), respectivamente. El peso al nacer, la talla, la edad gestacional y los partos prematuros no fueron significativamente diferentes. No se informaron anomalías sexuales en niños ( n = 29) de pacientes suplementados con DHEA después de 5 a 7 años de seguimiento.
Conclusiones: En conclusión, la suplementación con DHEA restableció los niveles séricos de estradiol y, cuando se incluyó en el protocolo de tratamiento, hubo una reducción estadísticamente significativa en los abortos espontáneos.
Introducción
El embarazo humano es un proceso complejo que requiere una estricta regulación del sistema materno para apoyar el desarrollo fetal y mantener un embarazo exitoso. La desregulación del sistema materno o las anomalías genéticas del feto pueden provocar la pérdida del embarazo, más comúnmente como aborto espontáneo ( 1 ). En algunos casos, se encuentra la causa del aborto espontáneo, que puede estar relacionada con factores genéticos, infecciosos o inmunológicos, o ser el resultado de anomalías en la implantación, la anatomía uterina o el sistema endocrino ( 2 , 3 ). Lamentablemente, en la mayoría de los casos no se identifica la etiología. Esto puede deberse a patologías subyacentes no identificadas en la investigación clínica de rutina o a factores que aún no se sabe que desempeñan un papel en un resultado adverso del embarazo ( 2 ).
Un factor pueden ser los bajos niveles de la hormona estradiol, que se descubrió hace casi un siglo ( 4 ). El estradiol juega un papel esencial en el embarazo, como se demuestra en modelos animales. En ratones, se demostró que el estradiol es esencial para la implantación ( 5 ). En babuinos, Albracht et al. demostró que una fuerte reducción en los niveles de estradiol inducía abortos espontáneos en el 50% de los embarazos ( 6 ). Estos abortos espontáneos se previnieron por completo mediante la suplementación con estradiol ( 6 ). En humanos, la importancia del estradiol en el embarazo está respaldada por el hecho de que actualmente se está investigando el fármaco inhibidor de la aromatasa letrozol como cotratamiento para inducir el aborto ( 7 ).
En el embarazo humano, la producción de estradiol aumenta aproximadamente 5 días después de la concepción ( 8 ), a través del cuerpo lúteo y luego alrededor de las 9 semanas de gestación por la placenta ( 9 , 10 ). Un pequeño número de estudios clínicos demuestran una correlación entre los niveles bajos de estradiol y resultados adversos del embarazo. En 1992, Check et al. demostró que los niveles séricos de estradiol eran significativamente más bajos durante los embarazos que terminaron en un aborto espontáneo ( 11 ). Esta observación se confirmó nuevamente en 2022 cuando Deng et al. informaron que los niveles de estradiol durante el embarazo eran significativamente más bajos en los embarazos abortados en comparación con los embarazos normales ( 12 ). Informes recientes demuestran que los niveles bajos de estradiol se correlacionan con resultados adversos del embarazo, como preeclampsia ( 13 – 15 ) y bebés pequeños para la edad gestacional ( 16 , 17 ). No está claro si estos niveles bajos de estradiol son causa o consecuencia de las complicaciones del embarazo; sin embargo, la biosíntesis de estradiol tendía a ser menor en la edad gestacional anterior a la preeclampsia ( 18 ).
La producción de estradiol se lleva a cabo mediante la conversión del colesterol en pregnenolona, dehidroepiandrosterona (DHEA), andrógenos y finalmente estradiol ( 19 ). La DHEA parece ser una prohormona clave para la producción de estradiol, ya que los niveles de estradiol en mujeres posmenopáusicas aumentan con la suplementación con DHEA ( 20 ). Se ha sugerido que la suplementación con DHEA antes del embarazo aumenta la tasa de embarazos espontáneos en mujeres con función ovárica disminuida ( 21 ). Además, Tagawa et al. encontró un aumento fisiológico de los niveles de DHEA en sangre en el primer y segundo trimestre del embarazo ( 22 ). Sin embargo, actualmente se desconoce el impacto de la suplementación con DHEA sobre los niveles de estradiol durante el embarazo.
En la clínica NeoFertility de Dublín, Irlanda, el tratamiento del embarazo temprano tiene como objetivo reducir el riesgo de aborto espontáneo en mujeres con antecedentes de infertilidad y/o abortos espontáneos recurrentes. Durante los últimos 12 años, la evaluación y el tratamiento al comienzo del embarazo han incluido el seguimiento de los niveles séricos de estradiol. Para las mujeres con niveles bajos de estradiol, se ha utilizado la suplementación con estradiol (en los primeros años de esta cohorte) o DHEA (en los últimos años de esta cohorte) para intentar normalizar los niveles séricos de estradiol y reducir el riesgo de aborto espontáneo. Estos tratamientos formaron parte de un enfoque multifactorial para restaurar la función reproductiva basado en síntomas y mediciones seriadas de los niveles hormonales, que evolucionaron durante el período de estudio. Para obtener más información sobre los niveles de estradiol durante los embarazos que resultaron en abortos espontáneos o partos a término, y para evaluar el impacto potencial de la suplementación con estradiol o DHEA en pacientes con estradiol sérico bajo durante el embarazo, analizamos retrospectivamente los niveles de estradiol sérico y el resultado del embarazo en pacientes embarazadas que o no fueron tratados con estradiol o DHEA.
Materiales y métodos
Configuración
Entre 2009 y 2017, una clínica de medicina reproductiva restaurativa (MRR) (ahora conocida como NeoFertility) operó en dos sitios en Irlanda, Galway y Dublín. Todos los pacientes reciben tratamiento médico para problemas de salud subyacentes y se tratan mientras intentan concebir de forma natural. Había cinco médicos que prestaban servicios durante este tiempo, todos los cuales tenían licencia para medicina familiar en Irlanda. Todos habían recibido capacitación en RRM, específicamente tecnología procreadora natural, que utiliza la tabla de fertilidad del modelo Creighton para evaluar el ciclo menstrual y la función reproductiva ( 23 , 24 ). Recibieron tutoría con el director médico de la clínica (PB) sobre los enfoques y procedimientos clínicos de RRM.
Registros médicos y recopilación de datos.
Los datos utilizados para este estudio se recopilaron de forma rutinaria de los pacientes durante sus visitas iniciales y posteriores, según se registró en los registros médicos. Información clínica adicional que habitualmente se recopila por teléfono, correo postal, correo electrónico o encuesta y se coloca en el expediente. Los datos necesarios para este estudio se extrajeron de los registros médicos existentes y se ingresaron en una base de datos, realizándose una verificación secundaria de la información según fuera necesario. Los datos extraídos se anonimizaron con identificadores únicos.
Control de rutina de los niveles de estradiol durante el embarazo
A partir de 2009, la clínica comprobó periódicamente los niveles séricos de estradiol en todos los embarazos. Por la mañana se realizó una extracción de sangre para análisis de estradiol sérico. Los análisis fueron realizados por laboratorios clínicos de toda Irlanda y se informaron en unidades estándar de pmol/L. Se determinó el día preciso de gestación en cada extracción de sangre, como se describe a continuación. Los niveles se comprobaron semanalmente en las primeras etapas del embarazo, antes de una ecografía para establecer la viabilidad temprana del embarazo, que generalmente se realizaba alrededor de las 7 semanas de gestación. Después de que se observó que el embarazo era viable en la ecografía, se continuaron controlando los niveles de estradiol a intervalos durante todo el embarazo.
Datos de referencia de estradiol en el embarazo.
Para identificar pacientes con niveles bajos de estradiol al comienzo del embarazo, a partir de 2009, Check y sus colegas utilizaron un rango de referencia para los niveles de estradiol en embarazos que llegaron a término a partir de trabajos anteriores, como se muestra en ( Tabla 1 ) ( 11 ). Además, para este artículo, generamos un rango de referencia de estradiol en esta población clínica analizando retrospectivamente los niveles de estradiol de 104 embarazos de mujeres que tuvieron partos únicos vivos a término, que no recibieron suplementos de estradiol, DHEA o pregnenolona, y que no Tiene diabetes mellitus gestacional. Para el primer trimestre del embarazo, el nivel de estradiol se analizó en intervalos de una semana: de 3 semanas 0 días a 3 semanas 6 días, de 4 semanas 0 días a 4 semanas 6 días, y así sucesivamente. Además, durante todo el embarazo, el nivel de estradiol se analizó en intervalos de 2 semanas: de 3 semanas 0 días a 4 semanas 6 días, de 5 semanas 0 días a 6 semanas 6 días, y así sucesivamente. Cada nivel de estradiol se asignó a su intervalo semanal o quincenal asociado y se promediaron todos los niveles de estradiol de todas las pacientes para cada intervalo de tiempo, así como el día preciso de gestación dentro de cada intervalo de tiempo. Esto dio como resultado un rango de referencia específico de la clínica para los valores de estradiol en embarazos, que se muestra en la Figura 1 , que utilizamos para todos los análisis posteriores en este artículo. En este grupo, también exploramos si los niveles de estradiol variaban según la edad materna.
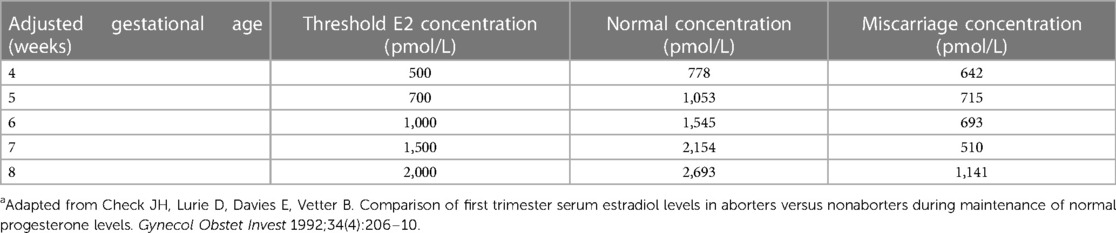
TABLA 1 . Umbral de estradiol sérico utilizado para iniciar la suplementación oral de estradiol o DHEA y niveles séricos objetivo deseados .
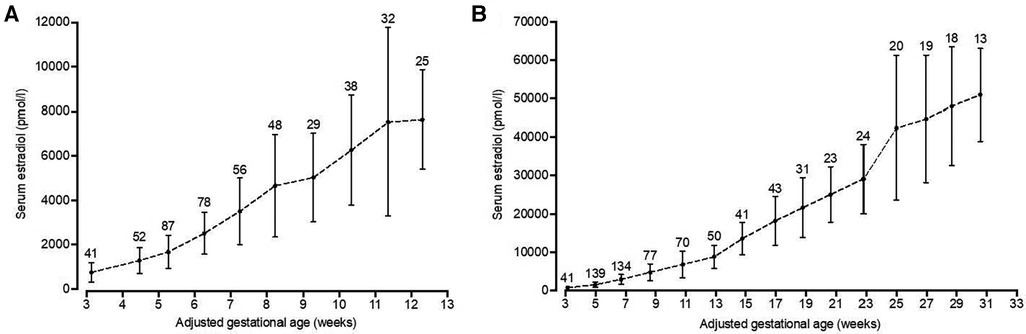
FIGURA 1 . Niveles séricos de estradiol durante el embarazo. Se analizaron retrospectivamente los niveles séricos de estradiol de pacientes con el último período menstrual entre abril de 2012 y julio de 2017 ( n = 104), que tuvieron partos a término (≥ 37 semanas) y no recibieron suplementos con estradiol, DHEA o pregnenolona. Se excluyeron del análisis las pacientes con embarazos múltiples o diagnosticadas de diabetes mellitus preexistente o gestacional. Los embarazos se seleccionaron de forma casi aleatoria dentro de este período de tiempo con el objetivo de incluir al menos 100 embarazos. Para el primer trimestre, los niveles de estradiol se promediaron a partir de intervalos semanales ( A ), mientras que para el embarazo completo se utilizaron intervalos quincenales ( B ). Los puntos de tiempo precisos de los intervalos semanales y quincenales se determinaron promediando los días de análisis de estradiol dentro de estos intervalos. Los datos se presentan como media con desviación estándar. El número encima de la línea indica el número de mediciones por punto de tiempo.
Análisis de los niveles relativos de estradiol durante el embarazo.
Los niveles relativos de estradiol sérico se obtuvieron dividiendo el valor absoluto de estradiol para cada paciente y la edad gestacional por el nivel de referencia respectivo del intervalo de edad gestacional asociado en los datos de referencia específicos de la clínica (niveles de referencia mostrados en la Figura 1 ), lo que arroja un porcentaje del nivel de estradiol específico de la edad gestacional. Los niveles relativos de estradiol sérico antes y después de la suplementación con estradiol o DHEA se obtuvieron calculando el promedio de todos los niveles relativos de estradiol obtenidos entre 1 y 10 días antes frente al promedio de todos los niveles relativos de estradiol disponibles obtenidos entre 1 y 6 semanas después de la suplementación, para cada el embarazo.
Criterios de inclusión y exclusión de pacientes.
Los criterios de inclusión para el análisis principal fueron todos los embarazos clínicamente identificados con niveles bajos de estradiol en el primer trimestre del embarazo, que no recibieron suplementos de estradiol o DHEA (2009-2011), o que fueron tratados con estradiol (2013-2015). o DHEA (2015-2017). Los criterios de exclusión fueron tener un estradiol sérico relativo basal >50% del nivel de referencia (específico para la edad gestacional), gestación múltiple, recibir suplementos tanto con estradiol como DHEA, haber recibido suplementos solo en el segundo o tercer trimestre, o no tener estradiol sérico. niveles disponibles antes o después de iniciar la suplementación, y presencia de un trastorno genético grave del feto. El número de mujeres excluidas para cada criterio se muestra en la Figura 2 .
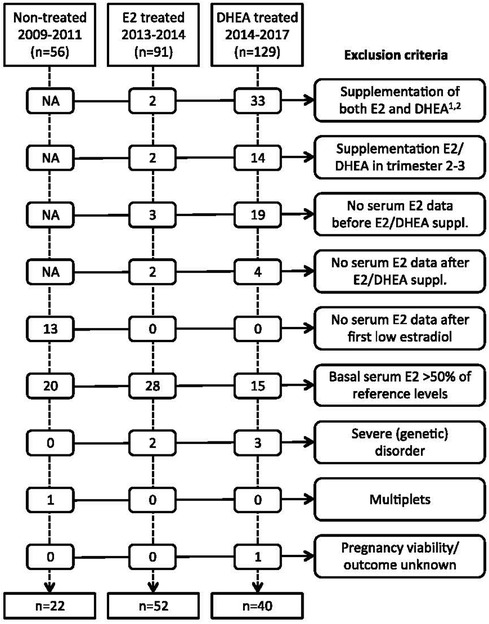
FIGURA 2 . Resumen de los criterios de exclusión. NA, no aplicable. 1 Para el año 2017, los pacientes con tratamiento con estradiol y DHEA no fueron extraídos de la base de datos de pacientes. En consecuencia, los 129 pacientes tratados con DHEA y los 33 pacientes excluidos del tratamiento combinado entre 2014 y 2017 representan una subestimación. 2 No hubo pacientes que recibieron pregnenolona antes de la suplementación con estradiol o DHEA o dentro de las primeras 6 semanas de la suplementación con estradiol o DHEA. E2, estradiol; DHEA, dehidroepiandrosterona.
Suplementación con estradiol o DHEA
El estradiol y la DHEA sólo están disponibles con receta médica en Irlanda. La suplementación fue mediante prescripción médica, con el medicamento obtenido en farmacia.
Identificación de edad gestacional, abortos espontáneos, embarazos viables y bebés pequeños/grandes para la edad gestacional.
La edad gestacional se determinó clínicamente mediante el día estimado de ovulación (día pico de moco) ( 25 , 26 ) y se confirmó mediante una ecografía temprana del embarazo con la longitud coronilla-rabadilla, generalmente a las 7 semanas de gestación. El aborto espontáneo se definió como la pérdida del embarazo antes de las 24 semanas de edad gestacional. La presencia de tamaño pequeño o grande para la edad gestacional al nacer se determinó utilizando los valores del percentil 10 de los estándares Intergrowth-21 para el peso del recién nacido ( 27 ). Asignamos el peso al nacer a una edad gestacional de × semanas y 0 a 3 días a la semana x, mientras que los días 4 a 6 se asignaron a la semana x + 1.
análisis estadístico
Los datos se presentan como media con error estándar de la media (SEM), a menos que se indique lo contrario. Se aplicó ANOVA unidireccional con corrección de Bonferroni para evaluar los niveles séricos de estradiol entre pacientes suplementados con estradiol y DHEA antes o después de la suplementación. Se aplicó ANOVA unidireccional con la prueba de diferencia honestamente significativa (HSD) de Tukey para evaluar los parámetros de resultado del embarazo. Se utilizó la regresión logística para determinar las probabilidades de aborto espontáneo en pacientes que recibieron estradiol o DHEA, en comparación con ninguna de las hormonas, sin ajustar y ajustada por la edad de la mujer, antecedentes de abortos espontáneos previos y antecedentes de nacidos vivos anteriores, que son características asociadas con la riesgo de aborto espontáneo. También ajustamos por el uso prescrito de otros medicamentos, además del estradiol o DHEA, que tuvieron diferencias sustanciales en la prevalencia entre los grupos de tratamiento.
Aprobación de ética
El estudio fue aprobado por el Comité de Ética en Investigación del Beacon Hospital (BHREC), número de referencia BEA0187. El análisis se realizó bajo la aprobación ética adicional de la Universidad de Utah, IRB #80947. Los datos se extrajeron de fuentes de datos clínicos habituales y se mantuvo el anonimato de los pacientes registrando los datos como no identificados antes del análisis. No hubo ningún requisito de consentimiento informado por escrito de los participantes.
Resultados
Pacientes
Para el análisis principal, analizamos los embarazos identificados con niveles iniciales de estradiol <= 50% del rango de referencia de edad gestacional, que no recibieron tratamiento con estradiol o DHEA ( n = 22; 2009-2011) o que recibieron estradiol ( n = 52; 2013-2015), o que recibieron DHEA ( n = 40; 2015-2017). Las características clínicas de estos embarazos (114 embarazos de 110 mujeres) se dan en la Tabla 2 . La edad media de las mujeres estaba en el rango de 36 a 37 años; más del 80% había tenido embarazos anteriores y el número medio de abortos espontáneos entre aquellas con embarazos anteriores fue de 2,1 a 2,4. La mayoría de las mujeres (86%–92%) recibieron progesterona durante el embarazo, además de otros tratamientos mostrados.
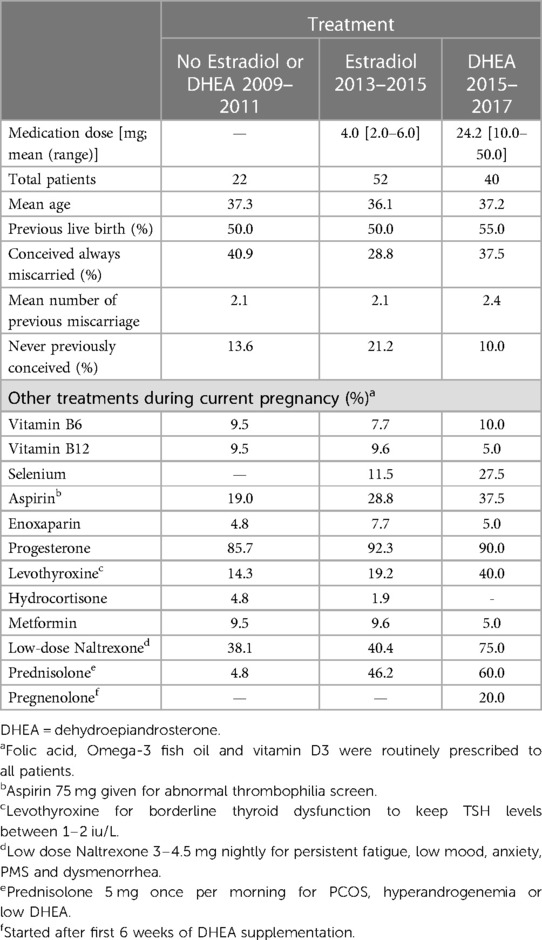
TABLA 2 . Características y otros tratamientos de 114 pacientes embarazadas con estradiol sérico bajo al comienzo del embarazo por tratamiento.
Niveles séricos de estradiol en embarazos que llegan a término
Como se describió anteriormente, los datos de referencia para el estradiol sérico durante el embarazo se generaron a partir de pacientes con embarazos a término entre 2012 y 2017, que no recibieron estradiol u otros medicamentos que pudieran aumentar los niveles de estradiol, incluidas DHEA y pregnenolona. Con el objetivo de analizar alrededor de 100 embarazos, se seleccionaron 126 embarazos. Después de excluir los embarazos múltiples o aquellos con diabetes mellitus preexistente o gestacional, se incluyeron 104 de 126 embarazos. En la Tabla 3 se presenta una descripción completa de las características clínicas y los tratamientos para esta población de referencia . El estradiol sérico medio una semana después de la ovulación estimada (p7) fue de 745 pmol/l ( n = 41) ( Figura 1A ). A lo largo del primer trimestre, estos niveles de estradiol aumentaron constantemente, lo que llevó a una media de 7643 pmol/L ( n = 25) en la semana 12 de embarazo. En el segundo y tercer trimestre, los niveles séricos de estradiol siguieron aumentando hasta la semana 31 hasta alcanzar una media de 50.986 pmol/L ( n = 13), después de lo cual el número de puntos de datos se consideró insuficiente para calcular las estimaciones medias ( Figura 1B ). Además, para explorar si la edad afectaba los niveles séricos de estradiol en esta población de pacientes, los 104 pacientes se dividieron en pacientes de ≤35 años ( n = 51, promedio de 32,5 años) y >35 años ( n = 53, promedio de 38,2 años) el día de la concepción. Los niveles de estradiol no fueron estadísticamente diferentes entre estos grupos de edad, aunque tendieron a ser más bajos en el grupo de mayor edad después de las 19 semanas de embarazo ( Figura 3 ).
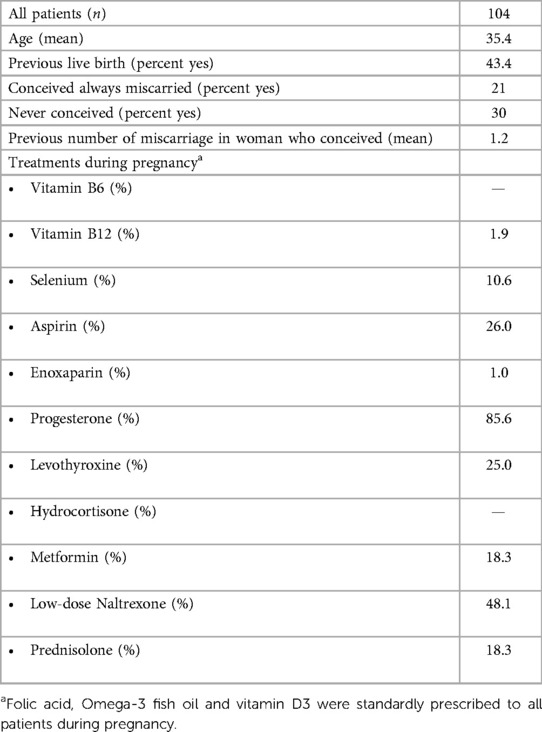
TABLA 3 . Características de la población de referencia: pacientes con estradiol sérico normal al inicio del embarazo y embarazos posteriores a término; Los datos de estas mujeres se utilizaron para derivar los valores de referencia en la Figura 1 .
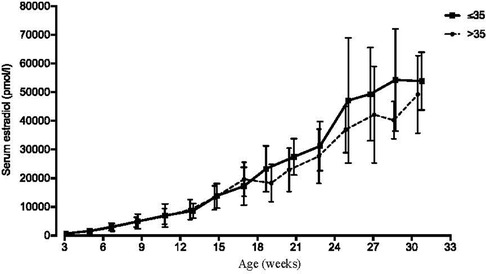
FIGURA 3 . Niveles séricos de estradiol en mujeres embarazadas más jóvenes y mayores. Se analizaron retrospectivamente los niveles séricos de estradiol de pacientes que no recibieron suplementos de estradiol entre 2012 y 2017 ( n = 104), que tuvieron partos a término. (Ver Figura 1 y Tabla 3. ) Para esta figura, los pacientes fueron estratificados en 35 años ( n = 51, promedio de 32,5 años) y >35 años ( n = 53, promedio de 38,2 años) en el día de la concepción. Se determinaron puntos de tiempo precisos de intervalos semanales y quincenales promediando los días de análisis de estradiol dentro de estos intervalos. Los datos se presentan como media con una desviación estándar.
La suplementación con DHEA es eficaz para aumentar el estradiol sérico
A partir de 2011, las mujeres embarazadas con niveles bajos de estradiol en sangre se identificaron clínicamente según los umbrales obtenidos de Check et al. ( 11 ) ( Tabla 1 ). Las mujeres con niveles bajos de estradiol recibieron suplementos de estradiol oral en 2013-2015 y de 2015-2017 con DHEA oral. Después de haber establecido una curva interna de estradiol de referencia para embarazos a término como se describió anteriormente y se muestra en la Figura 1 , se establecieron cohortes de pacientes suplementadas con estradiol y DHEA, según los criterios de inclusión y exclusión mencionados anteriormente, con los criterios de exclusión presentados en la Figura 2. . Esto llevó a la inclusión de 52 de 91 pacientes suplementadas con estradiol (último período menstrual entre mayo de 2013 y enero de 2015) y 40 de 129 pacientes suplementadas con DHEA (último período menstrual entre abril de 2015 y septiembre de 2017).
En promedio, tanto la suplementación con estradiol como con DHEA comenzaron a las 6,9 semanas de gestación. Los niveles relativos iniciales de estradiol fueron una media relativa de 32,3% y 33,2% de los niveles de referencia para el grupo de estradiol y DHEA, respectivamente, lo que no fue significativamente diferente. Después de la suplementación durante 1 a 6 semanas, esto alcanzó una media de 41,6% ( p = 0,14, en comparación con el nivel inicial) y 90,2% ( p <0,0001, en comparación con el nivel inicial) (mediana de 37,7% y 87,2%). La suplementación con DHEA condujo a niveles relativos de estradiol sérico significativamente más altos en comparación con la suplementación con estradiol ( p <0,0001). El estradiol oral no aumentó los niveles séricos de estradiol al 100% del nivel de referencia en ningún paciente, mientras que el 35% de los pacientes suplementados con DHEA alcanzaron este nivel ( Figura 4 ). Esta respuesta a la suplementación con DHEA se ilustra en pacientes representativos tratados solo con estradiol o DHEA y en pacientes que fueron tratados primero con estradiol, seguido de DHEA ( Figura 5 ). En 17 pacientes que recibieron suplementos de estradiol hubo una disminución en los niveles relativos de estradiol sérico, mientras que todos los pacientes que recibieron suplementos de DHEA tuvieron un aumento.
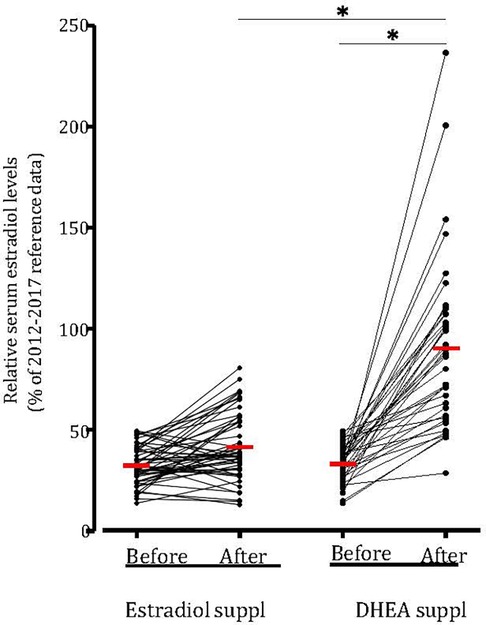
FIGURA 4 . La suplementación con DHEA aumentó los niveles relativos de estradiol sérico en todos los pacientes. Niveles séricos de estradiol (en pmol/L) de todos los pacientes con kvds bajos de estradiol y suplementados con estradiol ( n = 52) o con DHEA ( n = 40) en comparación con los datos de referencia de 2012-2017 y los niveles relativos de estradiol sérico. 1 a 10 días antes y 1 a 6 semanas después de la suplementación. Los valores se promediaron y compararon (marca roja). * p < 0,05 diferencia estadísticamente significativa. Suppl, suplementación.
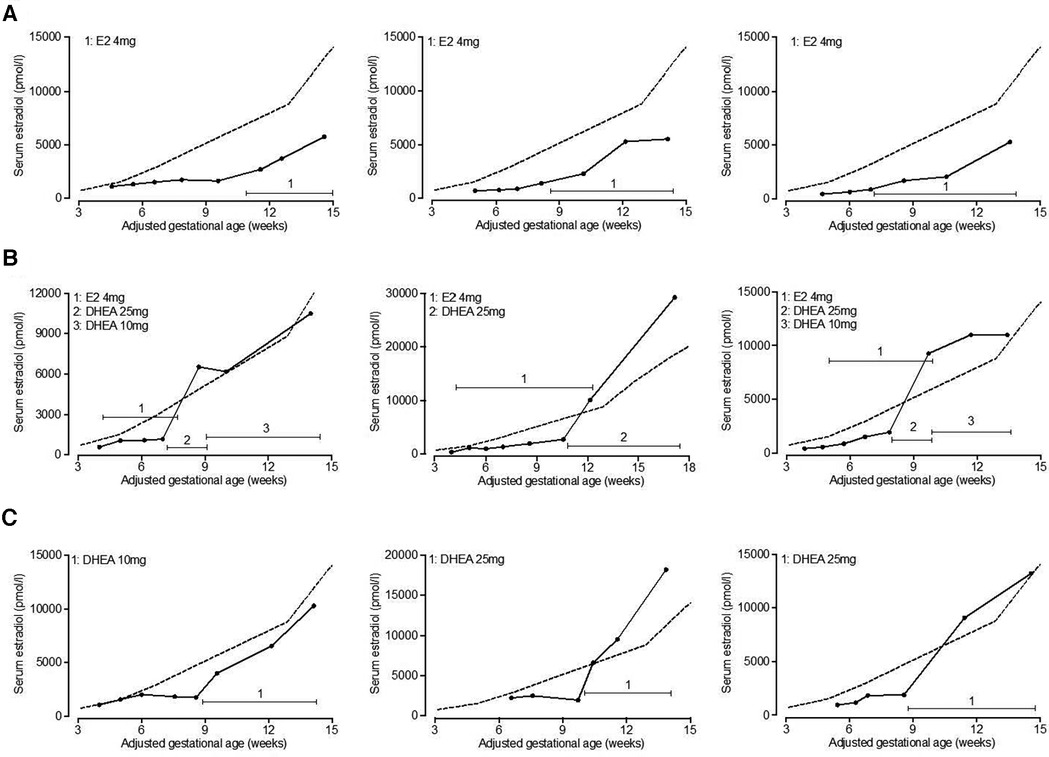
FIGURA 5 . Niveles séricos de estradiol en pacientes representativos suplementados con estradiol o DHEA. Se analizaron retrospectivamente los niveles séricos de estradiol en pacientes suplementados con estradiol o DHEA. Se muestran los niveles séricos de estradiol de pacientes representativos que inicialmente mostraron niveles bajos de estradiol sérico en relación con los niveles de referencia de 2012-2017 (indicados por la línea discontinua) y posteriormente fueron tratados solo con estradiol ( A ), estradiol seguido de DHEA ( B ) o solo DHEA ( C ). Está indicada la dosis total diaria de estradiol y DHEA. E2, estradiol; DHEA, dehidroepiandrosterona.
La suplementación con estradiol y DHEA se asoció con una menor incidencia de abortos espontáneos en comparación con pacientes no tratados
Para determinar el efecto potencial del aumento del estradiol sérico sobre la tasa de pérdida del embarazo, se compararon los resultados del embarazo en pacientes suplementadas con estradiol (cohorte 2013-2015) o DHEA (cohorte 2015-2017) con pacientes no tratadas (cohorte 2009-2011); Todas las pacientes inicialmente tenían niveles bajos de estradiol al principio del embarazo. Las características de los pacientes y otros tratamientos se presentaron en la Tabla 2 . Como se muestra en la Tabla 4 , en este último grupo la tasa de aborto espontáneo fue del 45,5%, mientras que fue del 17,5% para las pacientes suplementadas con DHEA ( p = 0,038) y del 21,2% ( p = 0,067) para las suplementadas con estradiol. No hubo diferencias significativas en las tasas de bajo peso al nacer o partos prematuros entre estos grupos, aunque el número de estos eventos fue pequeño. Al comparar los niveles de estradiol sérico en pacientes con embarazos viables o abortos espontáneos posteriores, encontramos que tanto en pacientes suplementadas con estradiol como con DHEA, los embarazos que resultaron en abortos espontáneos tuvieron un aumento atenuado de estradiol sérico con la suplementación ( Figura 6 ). Finalmente, también comparamos el inicio y la dosis de suplementación con estradiol y DHEA en los embarazos viables y los abortos espontáneos. Descubrimos que el inicio promedio de la suplementación con estradiol y DHEA fue respectivamente de 7,3 y 7,0 semanas en los embarazos viables y de 5,6 y 6,4 semanas en los abortos espontáneos, mientras que la dosis máxima promedio fue respectivamente de 4,1 y 24,1 mg en los embarazos viables y de 4,4 y 26,4 mg en los abortos espontáneos. , lo que indica que los embarazos a término con niveles bajos de estradiol sérico no estaban relacionados con una dosis más alta o una administración más temprana.
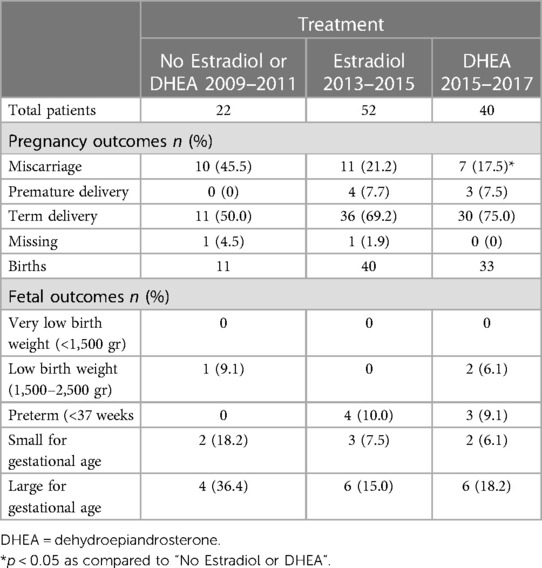
TABLA 4 . Suplementación con estradiol o DHEA y resultado del embarazo en 114 mujeres embarazadas con niveles bajos de estradiol sérico al comienzo del embarazo.
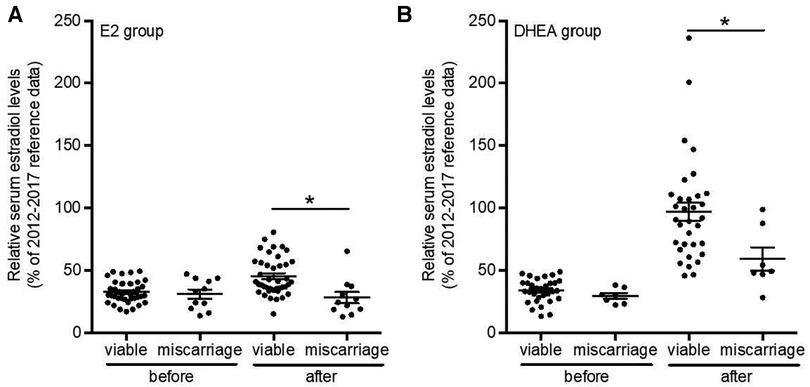
FIGURA 6 . Los niveles relativos de estradiol sérico después de la suplementación con estradiol o DHEA son más altos en embarazos viables. Se analizaron los niveles séricos de estradiol de todos los pacientes con niveles bajos de estradiol sérico y suplementados con estradiol ( n = 52) o con DHEA ( n = 40) con resultados de nacimiento conocidos y se analizaron los niveles relativos de estradiol sérico 1 a 10 días antes y 1 a 6 semanas después. suplementación y comparación entre embarazos viables y aquellos que conducen a un aborto espontáneo. * p < 0,05. Suppl, suplementación; E2, estradiol; DHEA, dehidroepiandrosterona.
En un modelo de regresión logística, el odds ratio (no ajustado) de aborto espontáneo fue de 0,32 para el tratamiento con estradiol y de 0,25 para el tratamiento con DHEA. En los modelos ajustados por la edad de la mujer, abortos espontáneos previos, nacimientos vivos anteriores y/o el uso de naltrexona y prednisolona, los odds ratios ajustados fueron muy similares, pero no estadísticamente significativos cuando se agregó el uso de naltrexona y prednisolona al ajuste ( Tabla 5 ). .
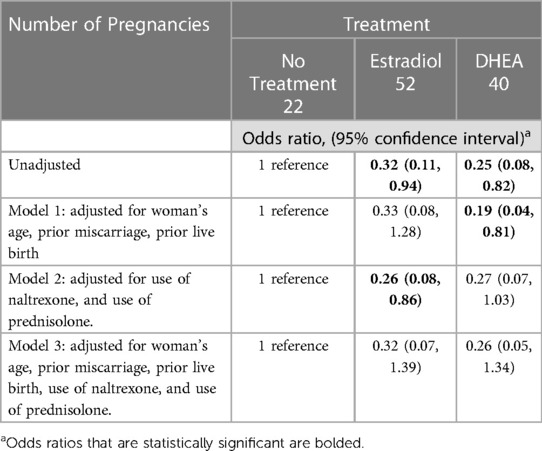
TABLA 5 . Odds ratio de aborto espontáneo con tratamiento con estradiol o DHEA, en referencia a ningún tratamiento, en mujeres con niveles bajos de estradiol sérico al comienzo del embarazo.
No se han notificado anomalías en el desarrollo sexual en el seguimiento a largo plazo de niños de pacientes tratados con DHEA
Se realizó un seguimiento clínico a los 5-7 años del nacimiento, utilizando el mismo cuestionario para todas las pacientes que recibieron DHEA durante el embarazo. El cuestionario informó sobre los parámetros del nacimiento, el modo de parto, las complicaciones para el feto o la madre durante el embarazo o en el momento del nacimiento, las preocupaciones sobre el desarrollo motor o cognitivo del niño y cualquier problema relacionado con la salud de los niños. El cuestionario fue completado por 29 de 33 niños. En alrededor del 20% de los embarazos se experimentaron complicaciones durante el embarazo y el parto ( Tabla 6 ). Se informaron pocas preocupaciones con respecto al desarrollo cognitivo o motor del niño, mientras que en el 34,5% de los niños se informaron preocupaciones relacionadas con la salud, incluyendo asma ( n = 3), pérdida auditiva progresiva ( n = 1), enfermedad de Blount ( n = 1), migraña. ( n = 1), hidronefrosis ( n = 1) y amígdalas agrandadas ( n = 1). No hubo informes de anomalías sexuales.
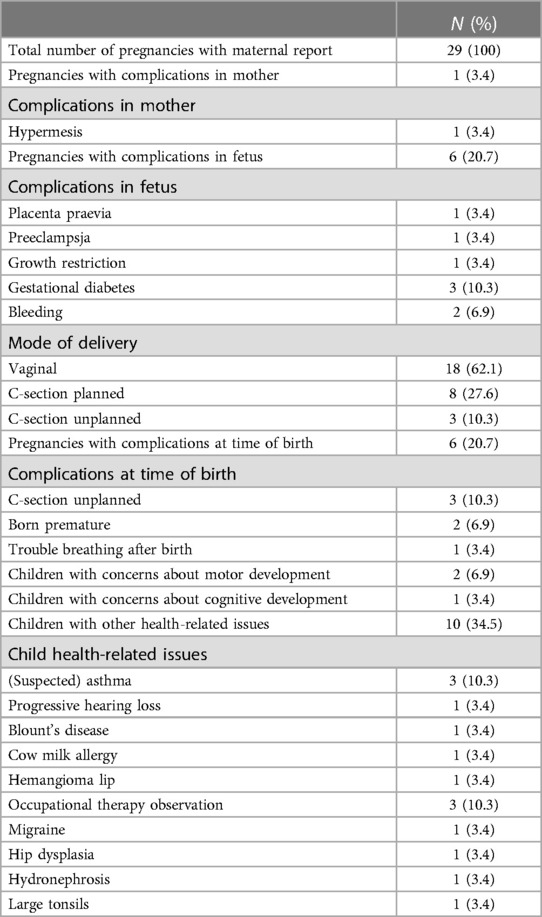
TABLA 6 . Resultados clínicos informados por las madres de embarazos tratados con DHEA, 5 a 7 años después del nacimiento.
Discusión
El papel esencial del estradiol en el embarazo se conoce desde hace muchas décadas; sin embargo, el impacto de los niveles bajos de estradiol en el resultado del embarazo ha sido objeto de relativamente poca investigación. En este análisis retrospectivo de embarazos de mujeres que asistieron a la clínica NeoFertility de Dublín por subfertilidad o complicaciones del embarazo entre 2009 y 2017, encontramos que la suplementación con DHEA fue muy eficaz para aumentar los niveles bajos de estradiol sérico, más que la suplementación directa con estradiol. También encontramos que el porcentaje de abortos espontáneos en los grupos suplementados con DHEA fue significativamente menor en comparación con pacientes similares que no recibieron DHEA ni estradiol. No se encontraron diferencias aparentes en el porcentaje de bebés con bajo peso al nacer, partos prematuros o bebés pequeños/grandes para la edad gestacional. Un cuestionario de seguimiento clínico dirigido a las madres sobre los hijos de los embarazos suplementados con DHEA no reveló ningún aumento aparente en los problemas de salud o la morfología sexual, aunque el número de niños estudiados es pequeño.
El aborto espontáneo coincide con niveles bajos de estradiol
Se estima que el aborto espontáneo ocurre hasta en el 30% de los embarazos, según la población, y aproximadamente la mitad de ellos ocurren dentro de las primeras semanas después de la concepción ( 28 , 29 ). Aunque se cree que las aberraciones genéticas causan alrededor del 50% de los abortos espontáneos en el primer trimestre ( 30 , 31 ), la causa subyacente en la mayoría de los abortos espontáneos no se identifica ( 32 ). Es fundamental identificar mejor los mecanismos fisiopatológicos para, en última instancia, brindar tratamiento, especialmente a las mujeres con abortos espontáneos recurrentes. En 1991, Check et al. demostró una fuerte correlación entre el resultado del embarazo y los niveles séricos de estradiol ( 11 ). Un nivel bajo de estradiol indicaría claramente una deficiencia en la producción de esteroides debido a una falta de estimulación de la LH o una respuesta celular a la LH durante las primeras etapas del embarazo. También podría indicar una deficiencia de la unidad suprarrenal-placentaria fetal durante y después de la transición a la producción placentaria de estradiol entre las 8 y 10 semanas. La suplementación con progesterona es un método más común para tratar la presunta deficiencia del cuerpo lúteo al principio del embarazo para reducir el riesgo de aborto espontáneo ( 33 ) y entre el 86 % y el 92 % de las pacientes de este estudio recibieron suplementos, sin diferencias entre los tres grupos de tratamiento. ( Tabla 2 ).
Niveles séricos de estradiol en embarazos sanos a término
Varios estudios más antiguos demostraron un aumento del estradiol sérico después de la concepción seguido de aumentos adicionales hasta el parto ( 11 , 34 , 35 ). Estos estudios utilizaron radioinmunoensayo para determinar el estradiol, mientras que actualmente el estradiol sérico se mide principalmente mediante inmunoensayos no marcados con radioisótopos o métodos basados en cromatografía líquida/espectrometría de masas en tándem ( 36 , 37 , 38 ). Estos últimos métodos también se han utilizado para determinar el estradiol sérico en embarazos sanos ( 39 , 40 ). Los ensayos de estradiol de este estudio se realizaron en diferentes laboratorios clínicos de Irlanda, lo que introduce un nivel desconocido de variación entre laboratorios. Por lo tanto, los niveles de referencia utilizados para este análisis no se pueden comparar directamente con otros laboratorios y entornos.
La suplementación con DHEA aumenta rápidamente los niveles séricos de estradiol
Entre las mujeres con niveles bajos de estradiol sérico al comienzo del embarazo, el nivel relativo medio de estradiol sérico aumentó del 33,2 % al 90,2 % ( p < 0,0001), después de la suplementación con DHEA.
Asociación de la suplementación con un número reducido de abortos espontáneos
Entre las mujeres con niveles bajos de estradiol sérico al principio del embarazo y sin suplementación, la incidencia de aborto espontáneo fue del 45,5%, en comparación con el 21,2% y el 17,5% para las pacientes suplementadas con estradiol y DHEA, respectivamente. En los modelos multivariables, al ajustar por el uso de dosis bajas de naltrexona y prednisolona (otros medicamentos que diferían entre los grupos de tratamiento) y/o por la edad de las mujeres, abortos espontáneos previos y nacidos vivos anteriores, hubo una reducción constante de las probabilidades (0,19-0,33 ) de aborto espontáneo con la suplementación de DHEA o estradiol, aunque solo algunos de los modelos tuvieron estimaciones del efecto que fueron estadísticamente significativas. Podría haber un mejor resultado cuando la suplementación se inicia muy temprano en el embarazo o antes del embarazo. Un estudio anterior demostró que la suplementación prolongada con DHEA antes del embarazo aumentaba el número de embarazos espontáneos en parejas que se estaban preparando para la FIV ( 21 ). Otro estudio anterior en dos centros encontró que las mujeres con reserva ovárica disminuida que recibieron suplementos de DHEA durante hasta dos meses antes del tratamiento de FIV tuvieron una tasa inesperadamente baja de aborto espontáneo (alrededor del 15%) ( 41 ).
Posibles mecanismos de acción.
Junto con la progesterona, el estradiol es esencial para la remodelación del útero para facilitar la implantación del embrión y la placentación, también conocida como decidualización ( 42 ). Además, el estradiol estimula la fase proliferativa del endometrio, tiene efectos vasodilatadores y es importante para la angiogénesis y, por tanto, la neovascularización ( 43 – 45 ), que es crucial para asegurar el transporte de oxígeno y nutrientes al feto en crecimiento.
Se cree que la DHEA funciona principalmente como precursor de esteroides para la producción de andrógenos y estrógenos ( 20 ). Durante la fase lútea del ciclo y las primeras 10 semanas de embarazo, la mayor parte de la progesterona y el estradiol son producidos por el cuerpo lúteo ( 46 ). Por lo tanto, lo más probable es que las células luteinizadas de la teca y/o la granulosa utilicen la suplementación con DHEA para esta producción de esteroides. Sin embargo, no podemos descartar la utilización periférica o suprarrenal, especialmente cuando la función ovárica es deficiente, como es el caso, por ejemplo, de las mujeres posmenopáusicas ( 20 ). Después de 10 semanas de gestación, es la placenta la que utiliza DHEA para producir estrógeno, como se analiza a continuación.
Preocupaciones de seguridad
Un riesgo potencial de la suplementación con estradiol es el posible desarrollo de trombosis ( 47 , 48 ), que también podría afectar negativamente el desarrollo placentario ( 49 , 50 ). Esta preocupación, junto con el hecho de que la suplementación con estradiol fue menos efectiva, lleva a una preferencia por el uso de DHEA durante el embarazo.
No hay literatura disponible sobre la suplementación prolongada con DHEA durante el embarazo. No obstante, existen varios estudios sobre la suplementación con DHEA a largo plazo antes de la FIV para mejorar el resultado del embarazo ( 21 , 51 ). En la mayoría de estos estudios se tomaron 25 miligramos de DHEA tres veces al día por vía oral durante un máximo de seis meses ( 51 – 53 ). La suplementación con DHEA se asoció con una disminución del número de abortos espontáneos ( 51 , 53 ). En ninguno de estos estudios se midieron los niveles séricos de DHEA o estradiol ( 51 ). Los efectos secundarios con estas dosis fueron mínimos; sin embargo, los reportados, como la caída del cabello, la piel grasa y el acné vulgar, están relacionados con sus efectos androgénicos ( 51 ). En mujeres posmenopáusicas, se encontró que la suplementación oral de 50 mg de DHEA por día durante 52 semanas era segura ( 54 ). No hay datos publicados sobre la suplementación prolongada con DHEA durante el embarazo.
En la clínica NeoFertility se controló cuidadosamente el estradiol sérico durante el embarazo y la DHEA solo se complementó con niveles bajos de estradiol sérico. Como la suplementación con DHEA en este estudio se limitó a mujeres con niveles bajos de estradiol sérico y nunca superó los 50 mg/día, creemos que es poco probable que haya niveles anormalmente altos de andrógenos séricos y efectos secundarios graves. Sin embargo, en este estudio no se midieron los niveles de andrógenos. Un aumento de los niveles de andrógenos en sangre podría afectar el desarrollo fetal, especialmente en los fetos femeninos.
El cambio de lútea a placenta en la síntesis de estradiol se completa alrededor de las 8 a 10 semanas de gestación ( 9 , 10 , 55 ). Sin embargo, la placenta sólo puede producir estrógeno si hay niveles suficientes de DHEA para la conversión enzimática. La DHEA para la producción de estrógeno proviene de una combinación de fuentes maternas y fetales, y la glándula suprarrenal fetal se vuelve predominante alrededor de las 10 semanas de gestación ( 55 ). Además, la producción de DHEA por la glándula suprarrenal fetal está estrechamente regulada ( 55 , 56 ), por lo que es muy probable que una mayor fuente materna de DHEA reduzca la producción por la glándula suprarrenal fetal, previniendo el exceso de androgenización. En nuestra encuesta a largo plazo sobre niños de embarazos suplementados con DHEA, no se informaron anomalías sexuales. En estudios futuros, la medición de los andrógenos fetales y la distancia anogenital al nacer sería valiosa para abordar esta posible preocupación.
Cualquier medicamento o suplemento utilizado durante el embarazo debe ser examinado minuciosamente para evitar daños al feto en desarrollo. Un ejemplo notorio de esto es el uso de dietilestilbestrol (DES) para la prevención de abortos espontáneos y partos prematuros entre 1938 y 1971 ( 57 ). El dietilestilbestrol también era una forma de suplementación con estrógeno, pero es un estrógeno sintético no esteroideo que tiene una estructura química modificada y una afinidad de 3 a 4 veces mayor por el receptor de estrógeno ( 57 ). Esta diferencia es probablemente la razón por la que se clasificó como cancerígeno para los humanos en 2000 ( 57 ) y ya no se utiliza. Esto contrasta con la DHEA, que es bioidéntica y se considera una hormona débil y un requisito fisiológico durante el embarazo que está estrictamente regulado.
Limitaciones del estudio
Nuestras observaciones del vínculo entre la suplementación con DHEA y los niveles de estradiol se realizaron en un entorno clínico y no se encontraron en la literatura publicada anteriormente. Sin embargo, una limitación importante de este estudio es su naturaleza retrospectiva y el número relativamente pequeño de embarazos tratados con DHEA. La asignación del tratamiento no fue aleatoria, sino que se modificó a lo largo de los períodos de las operaciones clínicas según los datos clínicos y la sintomatología. Aunque los grupos de tratamiento tenían características clínicas similares, existe la posibilidad de que existan otros factores de confusión no medidos. Otras tendencias temporales en el tratamiento (como se indica en la Tabla 2 ) pueden haber contribuido a las diferencias en los resultados de los pacientes que fueron tratados con DHEA. Se necesitan estudios controlados y aleatorios para confirmar nuestras observaciones y evaluar más a fondo los efectos adversos. Todas las pacientes de este estudio estaban siendo evaluadas y tratadas por subfertilidad y/o antecedentes de pérdida del embarazo y es posible que estos resultados no necesariamente se apliquen a otros tipos de pacientes.
Conclusiones
En conclusión, nuestros resultados respaldan trabajos previos que indican que los niveles bajos de estradiol sérico al comienzo del embarazo se asocian con el aborto espontáneo, demuestran que la suplementación con DHEA aumenta los niveles séricos de estradiol en mujeres que tienen niveles bajos de estradiol durante las primeras etapas del embarazo y sugieren que la administración de DHEA tiene el potencial de reducir la tasa de aborto espontáneo en embarazos con niveles bajos de estradiol sérico. Si bien el objetivo de nuestro tratamiento es reducir el aborto espontáneo, la naturaleza multifactorial del aborto espontáneo hace que sea difícil medir definitivamente una asociación con un tratamiento o biomarcador en un entorno clínico. Sin embargo, los niveles bajos de estradiol son un biomarcador fácilmente mensurable que potencialmente puede tratarse y debe validarse aún más como prueba de rutina y objetivo de terapia para abortos espontáneos recurrentes.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este artículo no están disponibles porque los datos se recopilaron a partir de registros médicos privados y no están disponibles públicamente. Los datos se pondrán a disposición de los editores de la revista o para consulta si es necesario previa solicitud. Las solicitudes para acceder a los conjuntos de datos deben dirigirse a Phil Boyle phil.boyle@neofertility.ie. Los datos sobre cualquiera de los sujetos del estudio no se han publicado previamente a menos que se especifique lo contrario. Los datos se pondrán a disposición de los editores de la revista para su revisión o consulta previa solicitud.
Declaración de Ética
Los estudios con humanos fueron aprobados por el Comité de Ética de Investigación del Beacon Hospital y la Junta de Revisión Institucional de la Universidad de Utah. Los estudios se realizaron de acuerdo con la legislación local y los requisitos institucionales. El comité de ética/junta de revisión institucional renunció al requisito de consentimiento informado por escrito para la participación de los participantes o de los tutores legales/familiares más cercanos de los participantes porque se trataba de un análisis retrospectivo de datos extraídos de los registros médicos existentes, anonimizados con identificadores únicos.
Contribuciones de autor
PB: Conceptualización, Curación de datos, Adquisición de fondos, Investigación, Metodología, Administración de proyectos, Recursos, Supervisión, Validación, Redacción – borrador original, Redacción – revisión y edición. KA: Conceptualización, Curación de datos, Análisis formal, Metodología, Validación, Escritura – revisión y edición. SV: Conceptualización, Validación, Redacción – revisión y edición. SN: Curación de datos, Análisis formal, Escritura – revisión y edición. TG: Conceptualización, Curación de datos, Análisis formal, Validación, Redacción – borrador original, Redacción – revisión y edición. CT: Conceptualización, Administración de proyectos, Redacción – revisión y edición. JS: Conceptualización, Curación de datos, Análisis formal, Metodología, Supervisión, Validación, Redacción – borrador original, Redacción – revisión y edición.
Fondos
El autor(es) declara haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo.
La financiación para este estudio se proporcionó a través del Instituto de Medicina Reproductiva Restaurativa en Estados Unidos (IRRMA).
Expresiones de gratitud
Agradecemos a Linda O’Neill (Clínica NeoFertility, Dublín, Irlanda) por su asistencia administrativa.
Conflicto de intereses
Los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
nota del editor
Todas las afirmaciones expresadas en este artículo son exclusivas de los autores y no necesariamente representan las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda evaluarse en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Quenby S, Gallos ID, Dhillon-Smith RK, Podesek M, Stephenson MD, Fisher J, et al. El aborto espontáneo importa: los costos epidemiológicos, físicos, psicológicos y económicos de la pérdida temprana del embarazo. Lanceta . (2021) 397(10285):1658–67. doi: 10.1016/S0140-6736(21)00682-6
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
2. Pinar MH, Gibbins K, He M, Kostadinov S, Silver R. Pérdidas tempranas del embarazo: revisión de la nomenclatura, histopatología y posibles etiologías. Pediatr Fetal Pathol . (2018) 37(3):191–209. doi: 10.1080/15513815.2018.1455775
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
3. Sharma D, Sharma P, Shastri S. Aspecto genético, metabólico y endocrino de la restricción del crecimiento intrauterino: una actualización. J. Matern. Medicina neonatal fetal . (2017) 30(19):2263–75. doi: 10.1080/14767058.2016.1245285
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
4. Simpson E, Santen RJ. Celebrando los 75 años del estradiol. J Mol Endocrinol . (2015) 55(3):T1–20. doi: 10.1530/JME-15-0128
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
5. Das A, Mantena SR, Kannan A, Evans DB, Bagchi MK, Bagchi IC. La síntesis de novo de estrógeno en el útero embarazado es fundamental para la decidualización del estroma y la angiogénesis. Proc Natl Acad Sci Estados Unidos . (2009) 106(30):12542–7. doi: 10.1073/pnas.0901647106
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
6. Albrecht ED, Aberdeen GW, Pepe GJ. El papel de los estrógenos en el mantenimiento del embarazo en primates. Soy J Obstet Gynecol . (2000) 182(2):432–8. doi: 10.1016/S0002-9378(00)70235-3
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
7. Behroozi-Lak T, Derakhshan-Aydenloo S, Broomand F. Evaluación del efecto del letrozol antes del misoprostol en comparación con el misoprostol solo en la tasa de éxito del aborto inducido. J Gynecol Obstet Hum Reprod . (2018) 47(3):113–7. doi: 10.1016/j.jogoh.2017.11.002
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
8. Stewart DR, Overstreet JW, Nakajima ST, Lasley BL. Secreción mejorada de esteroides ováricos antes de la implantación en las primeras etapas del embarazo humano. J Clin Endocrinol Metab . (1993) 76(6):1470–6. doi: 10.1210/jcem.76.6.8501152
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
9. Berkane N, Liere P, Oudinet JP, Hertig A, Lefevre G, Pluchino N, et al. Del embarazo a la preeclampsia: un papel clave de los estrógenos. Endocr Rev. (2017) 38(2):123–44. doi: 10.1210/año.2016-1065
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
10. Devoto L, Henríquez S, Kohen P, Strauss JF III. La importancia de los metabolitos del estradiol en la fisiología del cuerpo lúteo humano. Esteroides . (2017) 123:50–4. doi: 10.1016/j.esteroides.2017.05.002
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
11. Verifique JH, Lurie D, Davies E, Vetter B. Comparación de los niveles séricos de estradiol en el primer trimestre en quienes abortaron versus quienes no abortaron durante el mantenimiento de los niveles normales de progesterona. Gynecol Obstet Invest . (1992) 34(4):206–10. doi: 10.1159/000292762
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
12. Deng D, Sun R, Du J, Wu X, Ma L, Wang M, et al. Predicción de aborto espontáneo en el primer trimestre mediante estradiol sérico, progesterona y gonadotropina coriónica humana beta dentro de las 9 semanas posteriores a la gestación. BMC Embarazo Parto . (2022) 22(112):1–11. doi: 10.1186/s12884-021-04158-w
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
13. Wan J, Hu Z, Zeng K, Yin Y, Zhao M, Chen M, et al. La reducción de los niveles circulantes de estrógeno y progesterona en mujeres con preeclampsia. Hipertensión durante el embarazo . (2018) 11:18–25. doi: 10.1016/j.preghy.2017.12.003
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
14. Jobe SO, Tyler CT, Magness RR. Síntesis aberrante, metabolismo y acumulación plasmática de estrógenos circulantes y metabolitos de estrógenos en la preeclampsia, implicaciones para la disfunción vascular. Hipertensión . (2013) 61(2):480–7. doi: 10.1161/HIPERTENSIONAHA.111.201624
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
15. Hertig A, Liere P, Chabbert-Buffet N, Fort J, Pianos A, Eychenne B, et al. Perfil de esteroides en mujeres preeclámpticas: evidencia de deficiencia de aromatasa. Soy J Obstet Gynecol . (2010) 203(5):477.e1–9. doi: 10.1016/j.ajog.2010.06.011
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
16. Anelli GM, Mando C, Letizia T, Mazzocco MI, Novielli C, Lisso F, et al. Expresiones placentarias de ESRRG-CYP19A1 y 17-beta estradiol circulante en embarazos con RCIU. Pediatra frontal . (2019) 7:154. doi: 10.3389/fped.2019.00154
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
17. Salas SP, Marshall G, Gutiérrez BL, Rosso P. Evolución temporal del volumen plasmático materno y cambios hormonales en mujeres con preeclampsia o restricción del crecimiento fetal. Hipertensión . (2006) 47(2):203–8. doi: 10.1161/01.HYP.0000200042.64517.19
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
18. Berkane N, Liere P, Lefevre G, Alfaidy N, Nahed RA, Vincent J, et al. Esteroidogénesis anormal y actividad aromatasa en la preeclampsia. Placenta . (2018) 69:40–9. doi: 10.1016/j.placenta.2018.07.004
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
19. Tang J, Chen LR, Chen KH. La utilización de dehidroepiandrosterona como precursor de hormona sexual en mujeres premenopáusicas y posmenopáusicas: una descripción general. Productos farmacéuticos (Basilea, Suiza) . (2021) 15(1):1–22. doi: 10.3390/ph15010046
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
20. Zhu Y, Qiu L, Jiang F, Găman MA, Abudoraehem OS, Okunade KS, et al. El efecto de la suplementación con dehidroepiandrosterona (DHEA) sobre los niveles de estradiol en mujeres: una dosis-respuesta y un metanálisis de ensayos clínicos aleatorios. Esteroides . (2021) 173:108889. doi: 10.1016/j.esteroides.2021.108889
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
21. Fusi FM, Ferrario M, Bosisio C, Arnoldi M, Zanga L. La suplementación con DHEA afecta positivamente los embarazos espontáneos en mujeres con función ovárica disminuida. Ginecol. Endocrinol . (2013) 29(10):940–3. doi: 10.3109/09513590.2013.819087
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
22. Tagawa N, Hidaka Y, Takano T, Shimaoka Y, Kobayashi Y, Amino N. Concentraciones séricas de dehidroepiandrosterona y sulfato de dehidroepiandrosterona y su relación con la producción de citoquinas durante y después del embarazo normal. Clin Chim Acta . (2004) 340(1–2):187–93. doi: 10.1016/j.cccn.2003.10.018
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
23. Stanford JB, Parnell TA, Boyle PC. Resultados del tratamiento de la infertilidad con tecnología procreadora natural en una práctica general irlandesa. Junta J Am Fam Med . (2008) 21(5):375–84. doi: 10.3122/jabfm.2008.05.070239
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
24. Stanford JB, Parnell T, Kantor K, Reeder MR, Najmabadi S, Johnson K, et al. Evaluación y vigilancia internacional de la tecnología procreadora natural del tratamiento para la subfertilidad (iNEST): inscripción y métodos. Hum Reproducción abierta . (2022) 2022(3):hoac033. doi: 10.1093/hropen/hoac033
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
25. Fehring RJ. Precisión del día pico de moco cervical como marcador biológico de fertilidad. Anticoncepción . (2002) 66(4):231–5. doi: 10.1016/S0010-7824(02)00355-4
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
26. Stanford JB, Schliep KC, Chang CP, O’Sullivan JP, Porucznik CA. Comparación del día pico de moco cervical seleccionado por mujeres, expertos y por computadora con un aumento ciego de la hormona luteinizante en orina para la identificación simultánea de la ovulación. Pediatría Perinat Epidemiol . (2020) 34(2):105–13. doi: 10.1111/ppe.12642
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
27. Villar J, Cheikh Ismail L, Victora CG, Ohuma EO, Bertino E, Altman DG, et al. Estándares internacionales para el peso, la longitud y la circunferencia de la cabeza de los recién nacidos por edad gestacional y sexo: el estudio transversal de recién nacidos del proyecto INTERGROWTH-21st. Lanceta . (2014) 384(9946):857–68. doi: 10.1016/S0140-6736(14)60932-6
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
28. Wilcox AJ, Weinberg CR, O’Connor JF, Baird DD, Schlatterer JP, Canfield RE, et al. La incidencia de la pérdida temprana del embarazo. N Inglés J Med . (1988) 319(4):189–94. doi: 10.1056/NEJM198807283190401
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
30. Eiben B, Bartels I, Bähr-Porsch S, Borgmann S, Gatz G, Gellert G, et al. Análisis citogenético de 750 abortos espontáneos con el método de preparación directa de vellosidades coriónicas y sus implicaciones para el estudio de las causas genéticas del desperdicio del embarazo. Soy J Hum Genet . (1990) 47(4):656–63.2220806
31. Suzumori N, Sugiura-Ogasawara M. Factores genéticos como causa de aborto espontáneo. Curr Med Chem . (2010) 17(29):3431–7. doi: 10.2174/092986710793176302
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
32. Quintero-Ronderos P, Mercier E, Fukuda M, González R, Suárez CF, Patarroyo MA, et al. Nuevos genes y mutaciones en pacientes afectadas por pérdidas recurrentes de embarazos. Más uno . (2017) 12(10):e0186149. doi: 10.1371/journal.pone.0186149
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
33. Coomarasamy A, Devall AJ, Brosens JJ, Quenby S, Stephenson MD, Sierra S, et al. Progesterona vaginal micronizada para prevenir el aborto espontáneo: una evaluación crítica de evidencia aleatoria. Soy J Obstet Gynecol . (2020) 223(2):167–76. doi: 10.1016/j.ajog.2019.12.006
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
34. Berg FD, Kuss E. Concentración sérica y excreción urinaria de estrógenos, catecoleestrógenos y 2-metoxiestrógenos “clásicos” en el embarazo humano normal. Arco Ginecol Obstet . (1992) 251(1):17–27. doi: 10.1007/BF02718274
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
35. Tulchinsky D, Hobel CJ, Yeager E, Marshall JR. Estrona plasmática, estradiol, estriol, progesterona y 17-hidroxiprogesterona en el embarazo humano. I. Embarazo normal. Soy J Obstet Gynecol . (1972) 112(8):1095–100. doi: 10.1016/0002-9378(72)90185-8
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
36. Rosner W, Hankinson SE, Sluss PM, Vesper HW, Wierman ME. Desafíos para la medición del estradiol: una declaración de posición de la sociedad endocrina. J Clin Endocrinol Metab . (2013) 98(4):1376–87. doi: 10.1210/jc.2012-3780
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
37. Faupel-Badger JM, Fuhrman BJ, Xu X, Falk RT, Keefer LK, Veenstra TD, et al. Comparación de los métodos de cromatografía líquida-espectrometría de masas en tándem, RIA y ELISA para la medición de estrógenos urinarios. Biomarcadores del epidemiol del cáncer Anterior . (2010) 19(1):292–300. doi: 10.1158/1055-9965.EPI-09-0643
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
38. Taylor AE, Keevil B, Huhtaniemi IT. Espectrometría de masas e inmunoensayo: cómo medir las hormonas esteroides hoy y mañana. Eur J Endocrinol . (2015) 173(2):D1–12. doi: 10.1530/EJE-15-0338
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
39. Schock H, Zeleniuch-Jacquotte A, Lundin E, Grankvist K, Lakso H, Idahl A, et al. Concentraciones hormonales durante embarazos no complicados: un estudio longitudinal. BMC Embarazo Parto . (2016) 16(1):146. doi: 10.1186/s12884-016-0937-5
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
40. Friis Petersen J, Friis-Hansen LJ, Jensen AK, Nyboe Andersen A, Løkkegaard ECL. Intervalos de referencia del embarazo temprano; 29 analitos séricos de 4 a 12 semanas de gestación en embarazos concebidos de forma natural y sin complicaciones que resultan en nacimientos vivos. Clin Chem Lab Med . (2019) 57(12):1956–67. doi: 10.1515/cclm-2019-0495
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
41. Gleicher N, Ryan E, Weghofer A, Blanco-Mejía S, Barad DH. Tasas de aborto espontáneo después de la suplementación con dehidroepiandrosterona (DHEA) en mujeres con reserva ovárica disminuida: un estudio de casos y controles. Reprod Biol Endocrinol . (2009) 7:108. doi: 10.1186/1477-7827-7-108
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
42. Logan PC, Steiner M, Ponnampalam AP, Mitchell MD. Regulación del ciclo celular de las células del estroma endometrial humano durante la decidualización. Reproducción. Ciencia (Thousand Oaks, California) . (2012) 19(8):883–94. doi: 10.1177/1933719112438447
43. Corcoran JJ, Nicholson C, Sweeney M, Charnock JC, Robson SC, Westwood M, et al. Las arterias uterinas y placentarias humanas exhiben respuestas agudas específicas de tejido al 17 β -estradiol y agonistas específicos del receptor de estrógeno. Mol Hum Reproducción . (2014) 20(5):433–41. doi: 10.1093/molehr/gat095
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
44. Zhou K, Gao Q, Zheng S, Pan S, Li P, Suo K, et al. El 17β-estradiol induce vasorelajación al estimular la liberación endotelial de sulfuro de hidrógeno. Mol Hum Reproducción . (2013) 19(3):169–76. doi: 10.1093/mol/gas044
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
45. Morales DE, McGowan KA, Grant DS, Maheshwari S, Bhartiya D, Cid MC, et al. El estrógeno promueve la actividad angiogénica en células endoteliales de la vena umbilical humana in vitro y en un modelo murino. Circulación . (1995) 91(3):755–63. doi: 10.1161/01.CIR.91.3.755
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
46. Oliver R, Pillarisetty LS. Anatomía, Abdomen y Pelvis, Ovario Cuerpo Lúteo . Treasure Island, FL: StatPearls Publishing (2023). Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK539704/ (Actualizado el 1 de enero de 2023).
47. Beyer-Westendorf J, Bauersachs R, Hach-Wunderle V, Zotz RB, Rott H. Hormonas sexuales y tromboembolismo venoso: desde la anticoncepción hasta la terapia de reemplazo hormonal. VASA Zeitschrift fur Gefasskrankheiten . (2018) 47(6):441–50. doi: 10.1024/0301-1526/a000726
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
48. Fruzzetti F, Cagnacci A. Trombosis venosa y anticoncepción hormonal: ¿qué hay de nuevo con los anticonceptivos hormonales a base de estradiol? Anticonceptivo J de acceso abierto . (2018) 9:75–9. doi: 10.2147/OAJC.S179673
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
49. Devis P, Knuttinen MG. Trombosis venosa profunda en el embarazo: incidencia, patogénesis y manejo endovascular. Diagnóstico cardiovascular . (2017) 7 (Suplemento 3): S309–19. doi: 10.21037/cdt.2017.10.08
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
50. Skeith L. Prevención del tromboembolismo venoso durante el embarazo y el posparto: cruzar el umbral. Programa Hematol Am Soc Hematol Educ . (2017) 2017(1):160–7. doi: 10.1182/asheducation-2017.1.160
51. Fouany MR, Sharara FI. ¿Tiene algún papel la suplementación con DHEA en mujeres con reserva ovárica disminuida? J Assist Reprod Genet . (2013) 30(9):1239–44. doi: 10.1007/s10815-013-0018-x
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
52. Moawad AS, Shaeer M. La preparación con andrógenos a largo plazo mediante el uso de dehidroepiandrosterona (DHEA) mejora los resultados de la FIV en pacientes con mala respuesta. Un estudio controlado aleatorio. Medio Oriente Fertil Soc J. (2012) 17:268–74. doi: 10.1016/j.mefs.2012.11.002
53. Barad D, Brill H, Gleicher N. Actualización sobre el uso de suplementos de dehidroepiandrosterona entre mujeres con función ovárica disminuida. J Assist Reprod Genet . (2007) 24(12):629–34. doi: 10.1007/s10815-007-9178-x
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
54. Panjari M, Bell RJ, Jane F, Adams J, Morrow C, Davis SR. La seguridad de 52 semanas de terapia con DHEA oral para mujeres posmenopáusicas. Maturitas . (2009) 63(3):240–5. doi: 10.1016/j.maturitas.2009.03.020
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
55. Kaludjerovic J, Ward WE. La interacción entre el estrógeno y la corteza suprarrenal fetal. J Nutr Metab . (2012) 2012:1–12. doi: 10.1155/2012/837901
56. Mesiano S, Jaffe RB. Biología funcional y del desarrollo de la corteza suprarrenal fetal de primates. Endocr Rev. (1997) 18(3):378–403. doi: 10.1210/edrv.18.3.0304
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
57. Zamora-Leon P. ¿Se acabaron los efectos del DES? Una trágica lección del pasado. Int J Environ Res Salud Pública . (2021) 18:10309. doi: 10.3390/ijerph181910309
Resumen de PubMed | Referencia cruzada Texto completo | Google Académico
Palabras clave: embarazo, aborto espontáneo, estradiol, dehidroepiandrosterona, medicina reproductiva restauradora.
Cita: Boyle P, Andralojc K, van der Velden S, Najmabadi S, de Groot T, Turczynski C y Stanford JB (2024) Restauración del estradiol sérico y reducción de la incidencia de abortos espontáneos en pacientes con estradiol sérico bajo durante el embarazo: un estudio de cohorte retrospectivo utilizando un protocolo multifactorial que incluye DHEA. Frente. Reproducción. Salud 5:1321284. doi: 10.3389/frph.2023.1321284
Recibido: 13 de octubre de 2023; Aceptado: 8 de diciembre de 2023;
Publicado: 4 de enero de 2024.
Revisado por:
Bruno Miguel Fonseca , Universidad de Porto, PortugalEssam R. Othman , Universidad Assiut, Egipto
© 2024 Boyle, Andralojc, van der Velden, Najmabadi, de Groot, Turczynski y Stanford. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY) . Se permite el uso, distribución o reproducción en otros foros, siempre que se cite al autor(es) original(es) y al(los) propietario(s) de los derechos de autor y se cite la publicación original en esta revista, de acuerdo con la práctica académica aceptada. No se permite ningún uso, distribución o reproducción que no cumpla con estos términos.
*Correspondencia: Joseph B. Stanford joseph.stanford@utah.edu
Descargo de responsabilidad: todas las afirmaciones expresadas en este artículo son únicamente responsabilidad de los autores y no necesariamente representan las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda evaluarse en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
